Homocysteina- dlaczego warto dbać o jej prawidłowy poziom
Produkcja homocysteiny w naszym organizmie
|
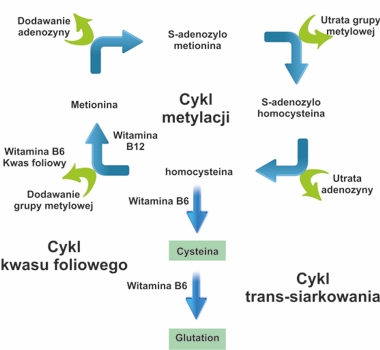
W wyniku trawienia białka ulegają rozpadowi do aminokwasów, w tym do niezbędnego (egzogennego) aminokwasu, jakim jest metionina. W wyniku dalszych przemian metionina ulega procesowi metylacji do homocysteiny. Nasz organizm usuwa homocysteinę poprzez przekształcenie jej ponownie do metioniny w procesie remetylacji lub przekształca ją w cysteinę (inny aminokwas) w procesie siarkowania, w efekcie czego powstaje antyoksydant glutation. W przemiany te zaangażowanych jest wiele enzymów działających w połączeniu z kofaktorami w postaci witamin z grupy B. Dzięki tym procesom organizm utrzymuje prawidłowy ( odpowiednio niski) poziom homocysteiny [1, 2]. |
|
|
|
|
Homocysteina i metylacja
Metylacja jest zasadniczym procesem potrzebnym, by zachodziły normalne podziały komórkowe i naprawa DNA [3]. W procesie metylacji wątroba przeprowadza liczne reakcje enzymatyczne i procesy metaboliczne konieczne by zachodziła detoksyfikacja naszego organizmu. Metylacja dostarcza organizmowi grup metylowych, które są wykorzystywane do innych procesów zależnych od metylacji takich, jak synteza kreatyniny, choliny, karnityny, koenzymu Q10, melatoniny czy białek otoczki mielinowej. Metylacja odgrywa również zasadniczą rolę w metabolizmie neurotransmiterów takich, jak dopamina, serotonina i metylowane fosfolipidy, które biorą udział w przekazywaniu sygnałów w błonach komórkowych. Niedostatecznie efektywna metylacja i procesy od niej zależne spowodowane są niewystarczającą ilością grup metylowych potrzebnych, by metylacja zachodziła lub niedoborem substancji odżywczych umożliwiających ten proces, do których w szczególności należy kwas foliowy oraz witamina B6 i B12. Jeśli detoksyfikacja organizmu jest utrudniona, jak również wtedy, gdy nasze DNA nie może być efektywnie naprawiane, w komórkach pojawiają się mutacje i uszkodzenia DNA, które zwiększają ryzyko rozwoju nowotworów. Nieefektywny proces metylacji przyspiesza również starzenie naszych komórek.
Inną substancją biorącą udział w odzykiwaniu grup metylowych z homocysteiny jest betaina (aminokwas). Jednak meachanizm z udziałem betainy funkcjonuje w wątrobie i nerkach, a mechanizm z udziałem folianu oraz witamin B6 i B12 jest uniwersalny dla wszystkich komórek. Betainę nasz organizm produkuje z innego aminokwasu - choliny. Doskonałym źródłem choliny są żółtka jaj.
Procesy, w których uczestniczy metylacja:
produkcja neurotransmiterów
detoksyfikacja
naprawa uszkodzonego DNA
namnażanie komórek, różnicowanie komórek, apoptoza (samodestrukcja komórek)

Akumulowanie się homocysteiny
Homocysteina jest produktem ubocznym metabolizmu metioniny i musi zostać ponownie przekształcona w metioninę na drodze remetylacji lub ulec przekształceniu w cysteinę. Kwas foliowy, witamina B6 i witamina B12 odgrywają kluczową rolę w konwersji homocysteiny do metioniny i cysteiny, a niedobór tych ważnych składników odżywczych powoduje zmniejszenie aktywności enzymów potrzebnych do tego procesu, co skutkuje zahamowaniem usuwania z organizmu homocysteiny i w efekcie hiperhomocysteinemią.
Cysteina, która powstaje jako produkt metabolizmu homocysteiny jets przekształcana do glutationu. Glutation jet niezwykle ważnym antyoksydantem, jego rola jest szczególnie ważna dla układu odpornościowego oraz dla oczyszczania z toksyn naszego mózgu
Zbyt wysoki poziom homocysteiny nie tylko prowadzi do uszkodzeń komórek bezpośrednio przez wytwarzanie stresu oksydacyjnego ale również poprzez utrudnianie metylacji i niedobór glutationu, co ma poważne skutki dla naszego zdrowia.
Homocysteina a zdrowie układu kardiowaskularnego
Choroby układu kardiowaskularnego takie, jak niedokrwienna choroba serca, udar, zastoinowa są jedną z najczęstszych przyczyn zgonów na świecie. Fakt, że podwyższony poziom homocysteiny w krwi stanowi czynniki ryzyka chorób układu kardiowaskularnego, w tym miażdzycy jest bardzo dobrze udokumentowany w literaturze [4, 5]. Ponieważ poziomy homocysteiny w krwi są bezpośrednio zależne poziomu witamin z grupy B (kwas foliowy, witamina B6 i B12) [6] suplementacja tymi składnikami odżywczymi stanowi doskonałą prewencję zmniejszająca ryzyko zachorowania na choroby serca u osób zdrowych (tzw. pierwotna prewencja), jak również stabilizuje układ kardiowaskularny u osób już chorych (wtórna prewencja).
Homocysteina i zaburzenia nastroju
Stwierdzono, że istnieje związek pomiędzy niskim poziomem folianu, witaminy B6 i B12 oraz podwyższonych poziomów homocysteiny a depresją [7]. Wydaje się to być związane z niskim poziomem S-adenosylometioniny (SAMe), a w konsekwencji zmniejszeniem produkcji neurotransmiterów [8, 9]. Do syntezy serotoniny, dopaminy i innych substancji działających w centralnym systemie nerwowym konieczny jest proces metylacji. Z tego powodu jeśli homocysteina nie ulega ponownemu przekształceniu w metioninę wpływa to bezpośrednio na poziom SAMe a to, w konsekwencji, wpływa na produkcję neurotransmiterów (regulujących nastrój) i melatoniny (regulującej sen). U osób z depresją, u których stwierdza się bardzo wysokie poziomy homocysteiny równocześnie stwierdza się bardzo niskie poziomy SAMe. Przywrócenie normalnych poziomów homocysteiny poprzez suplementację folianem, witaminą B6 i witaminą B12 wpływa regulująco na proces metylacji oraz metabolizm i uwalnianie neurotransmiterów [10].
Dlaczego suplementacja jest nie zawsze skuteczna i kiedy nie jest bezpieczna?
Większość suplementów oferowanych jako wskazane przy przywracaniu prawidłowego poziomu witamin niezbędnych w metabolizmie homocysteiny zawiera kwas foliowy. Kwas foliowy to syntetyczny związek, który nie występuje w naturze. Jednak może być wykorzystywany przez nasz organizm jak prekursor naturalnych biologicznie czynnych folianów. Aktywną formą jest związek o nazwie 5-metyltetrahydrofolian, a w jej tworzeniu z kwasu foliowego bierze udział enzym nazywany w skrócie MTHFR. Gen kodujący MTHFR charakteryzuje się polimorfizmem, czyli występuje w kilku odmianach, z których niektóre prowadzą do znaczących różnic w budowie kodowanego enzymu i wpływają na jego funkcjonowanie. Obecnie znanych jest 9 odmian tego genu, z których najpowszechniejsze to C677T i A1298C. Ponadto, zarejestrowano obecność w populacji ludzkiej przynajmniej 50 różnych mutacji w genie MTHFR, które upośledzają funkcjonowanie enzymu. Z tego powodu organizm niektórych ludzi nie jest w stanie przetworzyć kwasu foliowego do aktywnej formy folianu. Obecnie ocenia się, że problem ten dotyka przynajmniej 10% populacji, a w niektórych regionach jej częstotliwość sięga nawet 20%. W takim przypadka suplementacja kwasem foliowym jest nie tylko nieskuteczna ale także może stwarzać zagrożenie dla naszego zdrowia niezmetabolizowany kwas foliowy kumuluje się w naszej krwi i staje się toksyczny.
Bezpieczeństwo spożywania dużych ilości kwasu foliowego stoi obecnie pod znakiem zapytania również u osób, które nie cierpią na mutację genu MTHFR, zwłaszcza jeśli jest regularne i ma miejsce przez wiele lat. Na obecną chwilę w 83 krajach wprowadzone jest obowiązkowe wzbogacanie mąki pszennej kwasem foliowym. Wśród krajów europejskich proceder ten obowiązuje w Wielkiej Brytanii. Obowiązkiem takim jest objęta cała Ameryka Północna i Południowa, Australia, część krajów afrykańskich i kraje arabskie. W Polsce wzbogacanie mąki kwasem foliowym nie jest obowiązkowe ale niektórzy producenci również wprowadzili na rynek taką mąkę. Tymczasem badania naukowe pokazują, że niezmetabolizowany kwas foliowy obniża zdolność naszego układu odpornościowego do zwalczania nieprawidłowych komórek, w tym komórek w stanie przednowotworowym. Ponadto, zakumulowany niezmetabolizowany kwas foliowy przy jednoczesnym deficycie witaminy B12 sprzyja zaburzeniami ze strony centralnego systemu nerwowego i anemii, a także może przyspieszać wzrost istniejących już guzów nowotworowych.
Co zamiast kwasu foliowego?
Najbardziej biodostępną formą folianu dostępną obecnie w postaci suplementu jest 5-metyltetrahydrofolian glukozaminy. Inną aktywną formą folianu obecną w suplementach jest 5-metyltetrahydrofolian wapnia, który jest starszą generacją tej witaminy i jest mniej stabilny oraz słabiej rozpuszczalny w wodzie, a co za tym idzie mniej skuteczny. 5-metylhydrofolian glukozaminy został opatentowany przez włoską firmę biotechnologiczną Gnosis i znany jest pod handlową nazwą Quatrefolic.
Super B-Complex
Super B-Complex to zestaw synergistycznie działających 8 witamin B, w tym folianu Quatrefolic, z dodatkiem witaminy C. Forma i dawka zastosowanych w nim składników sprawiają, że charakteryzuje się wysoką biodostępnością i skutecznością. Witaminy B6, B12 i folian, które są kluczowymi substancjami zapewniającymi prawidłowy poziom homocysteiny w organizmie są w tym preparacie w najaktywniejszej formie i w dawce, która zgodnie z badaniami naukowymi jest uznawana za skuteczną.
Każda tabletka Super B-Complex zawiera:
- 200 mcg Quatrefolic (aktywny folian)
- 10 mg witaminy B6 (fosforan pirydoksalu) - 715% EU RDA
- 450 mcg witaminy B12 (metylkobalamina) - 23000% EU RDA
- 24 mg witaminy B3 (niacyna) - 150% EU RDA
- 18 mg witaminy B5 (kwas pantotenowy) - 300% EU RDA
- 10 mg witaminy B1 (hydrochlorek tiaminy) - 909% EU RDA
- 7 mg witaminy B2 (fosforan ryboflawiny) - 500% EU RDA
- 150 mcg witaminy B7 (biotyna) - 300% EU RDA
- 80 mg witaminy C (kwas askorbinowy) - 100% EU RDA
Bibliografia:
1. Scott JM, Weir DG (1998). Folic acid, homocysteine and one-carbon metabolism: a review of the essential biochemistry. Journal of cardiovascular risk 5:223-227.
2. Selhub J (2002). Folate, vitamin B12 and vitamin B6 and one carbon metabolism. The journal of nutrition, health & aging 6:39-42.
3. Crider KS, Yang TP, Berry RJ, Bailey LB (2012). Folate and DNA methylation: a review of molecular mechanisms and the evidence for folate's role. Advances in nutrition 3:21-38.
4. Wald DS, Law M, Morris JK (2002). Homocysteine and cardiovascular disease: evidence on causality from a meta-analysis. BMJ 325:1202.
5. Aronow WS, Ahn C (2000). Increased plasma homocysteine is an independent predictor of new coronary events in older persons. The American journal of cardiology 86:346-347.
6. Selhub J, Jacques PF, Wilson PW, Rush D, Rosenberg IH (1993). Vitamin status and intake as primary determinants of homocysteinemia in an elderly population. JAMA 270:2693-2698.
7. Tiemeier H, van Tuijl HR, Hofman A, Meijer J, Kiliaan AJ, Breteler MM (2002). Vitamin B12, folate, and homocysteine in depression: the Rotterdam Study. The American journal of psychiatry 159:2099-2101.
8. Stanger O, Fowler B, Piertzik K, Huemer M, Haschke-Becher E, Semmler A, Lorenzl S, Linnebank M (2009) Homocysteine, folate and vitamin B12 in neuropsychiatric diseases: review and treatment recommendations. Expert review of neurotherapeutics 9:1393-1412.
9. Bottiglieri T (2005). Homocysteine and folate metabolism in depression. Progress in neuropsychopharmacology & biological psychiatry 29:1103-1112.
10. Bottiglieri T, Laundy M, Crellin R, Toone BK, Carney MW, Reynolds EH (2000). Homocysteine, folate, methylation, and monoamine metabolism in depression. Journal of neurology, neurosurgery, and psychiatry 69:228-232.
11. Carmel R(2008). How I treat cobalamin (vitamin B12) deficiency. Blood 112:2214-2221.
W języku polskim opracowała:
Izabela Dobrowolska
doktor nauk biologicznych
konsultant naukowy firmy Igennus w Polsce.